Therapieformen
Chirurgische Therapie: die bilaterale subkapsuläre Orchiektomie ist der Goldstandard der Hormondeprivation, gegen den sich alle übrigen Therapieoptionen messen lassen müssen. Nach der chirurgischen Kastration fallen die Testosteronserumspiegel bereits nach 3–12 h in das Kastrationsniveau ab. Der operative Eingriff ist einfach und auch in Lokalanästhesie durchzuführen. Der Vorteil der chirurgischen Kastration ist in der sicheren, von der Compliance des Patienten unabhängigen, schnellen und kostengünstigen AT zu sehen. Die Nachteile dieser Art des Hormonentzugs liegen in der psychisch belastenden, irreversiblen Behandlungsmethode ohne Option der intermittierenden AT.
LHRH-Analoga: werden in der Therapie des fortgeschrittenen PCA seit vielen Jahren eingesetzt und stellen heutzutage die „Therapie der Wahl“ dar. Normale oder subnormale Konzentrationen des Testosterons erfordern eine Umstellung der Therapie. In der Vergangenheit wurde das nach subkapsulärer Orchiektomie erreichte Kastrationsniveau des Testosteronserumspiegels mit 50 ng/ml angegeben. Neue und empfindlichere Assays zeigen, dass die nach Orchiektomie zu erreichende Testosteronkonzentration bei <20 ng/ml liegt und somit von manchen Arbeitsgruppen als neuer Grenzwert des Kastrationsniveau definiert wird. Eine Analyse der verschiedenen LHRH-Agonisten zeigt, dass bis zu einem Drittel der Patienten nicht das erstrebte Kastrationsniveau unter der applizierten Therapie erreichen. Ob jedoch das Nichterreichen des Kastrationsniveaus von <20 ng/ml mit einem ungünstigeren Überleben assoziiert ist, ist unklar.
Aufgrund der initialen Stimulation der testikulären Hormonproduktion muss bei metastasierten Patienten zur Vermeidung des flare-up-Phänomens eine über 14 Tage vorausgehende und bis zu 1 Woche nachfolgende Rezeptorblockade mit AAT erfolgen.
LHRH-Antagonisten: hier ist das seit etwa einem Jahr in Österreich zugelassene Degarelix zu erwähnen. Dieser LHRH-Antagonist ist monatlich zu applizieren (Erstdosis:240mg, dann 80mg), 95% der behandelten Patienten erreichen das Kastrationsniveau bereits nach 3 Tagen. Somit ist diese Therapieform vor allem bei symptomatischen Patienten in Alternative zur chirurgischen Therapie indiziert.
Bicalutamid: ist das bestuntersuchte und in Österreich einzig gebräuchliche AAT in der Monotherapie des PCA. Bicalutamid ist in einer Dosierung von 150 mg/Tag entsprechend der aktuellen Leitlinien bei fortgeschrittenem PCA mit geringer Metastasenlast als therapeutische Alternative zur medikamentösen oder chirurgischen Kastration indiziert, während bei ausgedehnter Metastasenlast LHRH-Analoga favorisiert werden sollten.
Im Rahmen der Monotherapie mit Bicalutamid sind Gynäkomastie und Mastodynie die in einer Frequenz von 45–60% (bis 85% ohne Mamma-Bestrahlung) am häufigsten auftretenden therapieassoziierten Nebenwirkungen. Eine effektive Prophylaxe kann und sollte durch eine prophylaktische Mamillenbestrahlung mit 12–15 Gy erfolgen, die zu einer signifikanten Reduktion der Beschwerden führt.
Flutamid: neben Bicalutamid ist vereinzelt noch Flutamid im monotherapeutischen Einsatz bei PCA. Es muß 3x täglich eingenommen werden und weist vermehrt gastrointestinale NW aus. Eine Gynäkomastie wird in < 50% beschrieben, es gibt keine Mastodynie.
Intermittierende Androgendeprivation (IAD): bis dato wurden insgesamt 15 klinische Phase-II-Studien zur IAD beim PCA publiziert, allerdings sind die Resultate der Studien aufgrund der Heterogenität der therapierten Patienten nur schwer zu interpretieren. Darüber hinaus existiert eine Phase-III-Studie, die allerdings sehr umstritten ist. Im Wesentlichen haben sich nur 5 Studien der Behandlung bereits metastasierter Patienten angenommen, die größte einheitliche Gruppe mit >100 Patienten wurde 2003 im European Urology publiziert.
In aller Regel wird die IAD mit einer MAB begonnen und über 6-9 Monate fortgesetzt und/oder bis ein PSA-Nadir ?4 ng/ml erreicht ist; anschließend erfolgt eine Therapiepause bis sich der PSA-Serumspiegel im Bereich von 10–20 ng/ml befindet. Dieser zyklische Verlauf wird solange wiederholt, bis sich ein androgenunabhängiges Tumorstadium entwickelt und ein PSA-Nadir <4 ng/ml nicht mehr erreicht werden kann. Die mittlere Dauer des Therapiezyklus bis zur erneuten Androgendeprivation beträgt 16–18 Monate mit einem Anteil therapiefreier Zeit von ca. 45%. Ziel der IAD ist eine Reduktion der Nebenwirkungen im therapiefreien Intervall, die (theoretische) Verzögerung der Entwicklung eines kastrationsresistenten Tumors. Diese Therapieform ist im Vergleich zur AT schlecht dokumentiert, wird aber nicht mehr als rein experimentell eingestuft und ist in den EAU-Leitlinien als mögliche Therapieform angegeben.
Maximale Androgenblockade (MAB): in einer Metaanalyse aus 27 Publikationen aus dem Jahr 2000 flossen 8.000 Männer ein. Insgesamt zeigte der Zusatz eines Antiandrogens zur AT je nach Stadium und Aggressivität des Tumors einen Unterschied im Gesamtüberleben von 2 bis max. 5% zugunsten der MAB. Bei einer beträchtlichen Zunahme der NW ist dieser Unterschied für die meisten Patienten nicht ausreichend relevant, sodass die MAB kaum Einsatz findet.
Nebenwirkungen
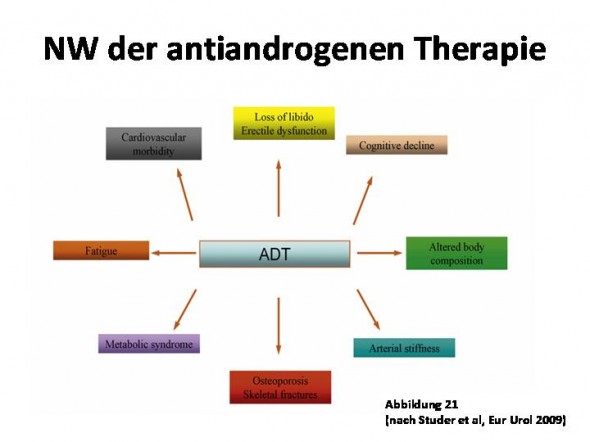
Unbestritten ist heutzutage auch die Vielzahl möglicher Nebenwirkungen einer AT oder AAT, eine Übersicht findet sich in einer aktuellen Publikation in Abbildung 1.
Während Urologen gute Kenntnisse bezüglich der sexuellen Nebenwirkungen (erektile Dysfunktion, Libidoverlust) und auch der negativen Auswirkungen auf die Knochendichte haben, werden nun immer deutlicher Auswirkungen auf den Glukose- und Lipidstoffwechsel publiziert, die gemeinsam mit Auswirkungen auf den Körperfettanteil zu einer Zunahme des metabolischen Syndroms und des kardiovaskulären Risikos resultieren. Immerhin ist eine AT gemäß einer US-amerikanischen Analyse bei 2,9% aller versicherten Männer laufend.
Dies führt neben einer nachgewiesenen Erhöhung der Frakturrate auch zu einer möglicherweise erhöhten Rate an kardiovaskulären Erkrankungen.
Eine internistische Abklärung vor Therapiebeginn ist jedoch gemäß einer Stellungnahme der amerikanischen Gesellschaften für Strahlentherapie, Kardiologie und Urologie derzeit noch nicht gefordert. Eine regelmäßige Kontrolle des Glukose- und Lipidstoffwechsels sollte aber kurzfristig angestrebt werden.
In ausgewählten Indikationen scheint die AAT bezüglich des Nebenwirkungsprofils hinsichtlich der Auswirkungen auf den Knochenstoffwechsel und die Körperfettverteilung der AT überlegen. Eine vorteilhaftere Situation bezüglich der sexuellen Funktionsstörungen ist wenig nachgewiesen und im Sinne einer verbesserten Gesamtlebensqualität nicht fundiert.
Die beste Möglichkeit, die vielfältigen Folgewirkungen einer AT oder AAT bei PCA zu minimieren, ist sicher die strenge Indikationsstellung, sowie die Prophylaxe potenzieller Probleme durch gegebenenfalls Vorstellung in einer Osteoporoseambulanz, Lebensstilmodifikationen und gesteigerte physische Aktivität.
Indikationen
Eine grundsätzliche Übersicht über mögliche Indikationen zur AT oder AAT findet sich in Abbildung 2 gemäß der EAU-Leitlinien 2010.
Lokalisiertes PCA mit active surveillance, Radikaloperation, externer Radiatio oder Brachytherapie: für Patienten mit einem lokal begrenzten PCA stellt die AT oder AAT in keiner Therapieform eine Indikation dar. Hier ist gemäß der gängigen Leitlinien (EAU, DGU) kein krankheitsspezifischer Vorteil zu erwarten. Eine Analyse der EPC-Studie bezüglich AAT dieses Tumorstadiums zeigte sogar eine reduzierte Überlebensrate im Vergleich zu Männern ohne Therapie.
Lokal fortgeschrittenes PCA mit Prostatektomie: die AT als neoadjuvante Therapieform vor Prostatektomie wird in allen gängigen Leitlinien, einschließlich der EAU-Leitlinien oder der S3-Leitlinien der DGU abgelehnt. Metaanalysen der vorliegenden, randomisierten Studien kommen einheitlich zum Schluss, dass die Rate positiver Schnittränder, lokal fortgeschrittener TU-Stadien oder positiver Lymphknoten reduziert werden, eine Auswirkung auf das karzinomspezifische- oder Gesamtüberleben jedoch nicht gezeigt werden konnte. Die AT oder AAT im adjuvanten Einsatz nach Radikaloperation wird ebenso einheitlich als mögliche Therapieform abgelehnt.
Lokal fortgeschrittenes PCA mit Radiatio: in dieser Indikation liegen die besten Studiendaten vor, die einen Einsatz der AT in diesem setting klar indizieren und auch bezüglich timing und Dauer festgelegt sind.
Die EORTC-Studie 22863 rekrutierte 415 Patienten mit einem lokal begrenzten oder einem lokal fortgeschrittenem, aber metastasenfreien PCA und untersuchte den Effekt der adjuvanten ADT mit LHRH-Analoga über 3 Jahre. Nach einem mittleren Follow-up von 66 Monaten wurde ein statistisch signifikanter Vorteil der adjuvanten Therapie bezüglich des Gesamtüberlebens (78 vs. 62%), des metastasenfreien Überlebens (78 vs. 40%) sowie der lokalen Rezidivrate (1,7 vs. 16,4%) festgestellt.
In der RTOG 85–31-Studie wurden 977 Patienten mit einem lokal fortgeschrittenen PCA rekrutiert, um den Effekt der adjuvanten gegen die verzögerte ADT mit LHRH-Analoga im dokumentierten Progress zu untersuchen. Nach einem mittleren Follow-up von 7,3 Jahren errechnete sich für die adjuvante Therapie ein signifikanter Vorteil des Gesamtüberlebens nach 5 (76 vs. 71%) und 10 Jahren (53 vs. 38%).
Auch die Dauer der Therapie wurde prospektiv kontrolliert untersucht. In einer rezenten EORTC-Studie 22961 zeigte sich der Einsatz einer LHRH-Therapie über 3 Jahre gegenüber 6 Monaten als überlegen im Sinne des karzinomspezifischen Überlebens.
Zusammenfassend wird in den aktuellen Leitlinien aufgrund der genannten Ergebnisse die Empfehlung ausgesprochen, eine adjuvante ADT nach perkutaner Radiatio je nach Risikostratifizierung wegen lokal fortgeschrittenem PCA für die Dauer von 2–3 Jahren durchzuführen.
Lokal fortgeschrittender Tumor, keine Primärtherapie: aktuelle Daten der EORTC-Studie 30891, die 1.002 Patienten mit einem lokal fortgeschrittenen, asymptomatischen PCA prospektiv randomisiert einer sofortigen AT durch medikamentöse oder chirurgische Kastration bzw. einer verzögerten Therapie im symptomatischen Progress zuführten, zeigen nach einer mittleren Nachbeobachtungszeit von 10 Jahren das Gesamtüberleben in der Gruppe der sofort androgendeprivierten Patienten signifikant günstiger (36,1% versus 25%). Allerdings ergab sich kein statistisch signifikanter Vorteil in Bezug auf das tumorspezifische Überleben (29% versus 26,2%). 25,6% verstarben nicht tumorbedingt, ohne eine ADT trotz fortgeschrittenem PCA benötigt zu haben. Die Daten dieser prospektiven Studie verdeutlichen, dass eine individuelle Abwägung der Vor- und Nachteile der ADT vor Therapiebeginn erfolgen muss.
Eine Nachfolgeanalyse dieses trials zeigte, dass speziell Männer über 70 Jahre, mit einem PSA unter 50 ng/ml oder Männer mit einer PSA-Verdoppelungszeit über 1 Jahr nicht von einer sofortigen Therapie profitierten.
Studien aus der prä-PSA-Ära (VACURG I und II, MRC-trial) sind heute bei engmaschigem follow-up nur mehr sehr schwierig bezüglich ihres Stellenwertes in modernen Therapiealgorithmen zu interpretieren.
Zusammenfassend sollte Patienten mit einem lokal fortgeschrittenen PCA ohne lokale Primärtherapie (nicht möglich, nicht gewünscht) zur Verlängerung des asymptomatischen Intervalls eine Hormontherapie angeboten werden. Eine Verbesserung des karzinomspezifischen Überlebens ist jedoch nicht zu erwarten.
Lymphknotenpositiver Patient ohne Lokaltherapie: in der erst jüngst publizierten EORTC-Studie 30846 zeigte sich bei 234 Patienten im Stadium N1-3 ohne Lokaltherapie mit einem follow-up von 13 Jahren ein nichtsignifikanter Unterschied im karzinomspezifischen Überleben von 22% zugunsten der soforttherapierten Männer (sofortige versus verzögerte AT). Aufgrund der nicht erreichten power zum Nachweis einer nicht-Unterlegenheit ist ein gültiger Schluss aus dieser aktuellen Studie, sowie aus retrospektiven Daten zu dieser Fragestellung nicht möglich. Eine einheitliche Therapieempfehlung der Leitlinien in dieser Situation liegt nicht vor.
Lymphknotenpositiver Patient nach Prostatektomie: für Patienten mit positiven Lymphknoten nach Prostatektomie liegt derzeit nur die altbekannte Studie von Messing vor. Diese Serie, die 98 Männer im Stadium pN1 in frühe versus verzögerte AT randomisierte zeigte ein signifikant besseres Überleben nach 10 Jahren, wird aber in wesentlichen Punkten kritisiert. Speziell der deutliche selection-bias, der in der Rekrutierungszeit von etwa 10 Jahren begründet liegt, aber auch die Tatsache, dass die Studie aus der prä-PSA-Ära stammt, lassen für die Mehrheit der heute tätigen Urologen eine adjuvante AT bei pN1 nicht zwingend erscheinen. In diesem Stadium sollte in Zusammenschau mit der Aggressivität des Tumors (Gleasonscore, lokaler Befund, PSA, PSA-Verlauf), dem Zustand des Patienten und der Anzahl der positiven Lymphknoten das weitere Vorgehen abgewogen werden.
Steigendes PSA nach erfolgreicher Lokaltherapie: zu dieser Fragestellung liegen nur sehr wenige, entweder unterpowerte oder retrospektive Studien vor. Gemäß der NICE-Leitlinie wird für diese Indikationsstellung die indirekte Evidenz aufgrund eines systematischen Reviews zur frühen versus späte Hormonbehandlung bei lokal fortgeschrittenem Prostatakarzinom angegeben. Eine antiandrogene Therapie sollte demzufolge nur eingesetzt werden bei einer PSA-Verdopplungszeit <3 Monate, symptomatischer lokaler Progression oder nachgewiesener Fernmetastasierung.
Metastasiertes PCA: Hier besteht der klare Konsens, dass im symptomatischen Stadium die AT als obligatorische first-line-Therapie unmittelbar indiziert ist. Es ist jedoch darauf hinzuweisen, dass es sich um eine palliative Therapieform handelt.
Im Gegensatz dazu, sind die Empfehlungen im asymptomatisch-metastasierten Stadium für das PCA nicht einheitlich. Da auch hier kein Nachweis einer Verlängerung des karzinomspezifischen- oder Gesamtüberlebens vorliegt, soll eine Therapie angeboten werden, eine Risiko-/Nutzenabwägung soll aber mit dem Patienten abgesprochen werden.
Neben einer Verlängerung des progressionsfreien Überlebens gibt es Hinweise darauf, dass eine frühzeitig eingeleitete AT Komplikationen infolge einer Progression der Grunderkrankung reduziert.
Zusammenfassung
Seit ihrer Etablierung vor etwa 6 Jahrzehnten ist die Androgenentzugstherapie eine der wesentlichen Möglichkeiten zur Therapie des PCA. Dass mit Ausnahme der adjuvanten Therapie bei Radiatio für eine Verbesserung des Gesamtüberlebens, sowie zur Palliation bei symptomatisch-metastasiertem Stadium keine zwingenden Indikationen bis dato wissenschaftlich fundiert nachgewiesen werden konnten ist heutzutage ein Aufruf an den behandelnden Urologen zur genauen Prüfung des Wirkungs-Nebenwirkungsprofil.
Literatur beim Verfasser.